Este artículo se publicó hace 15 años.
La tabla periódica se complica
Tras 15 años de investigación, se incluirán intervalos en los pesos atómicos de diez elementos clave
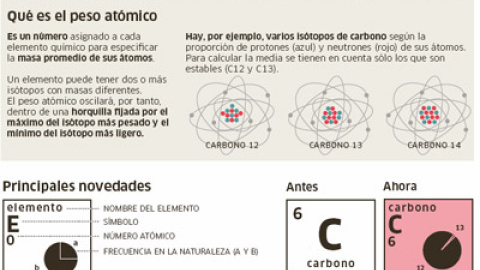
Estudiarse (o copiar) la tabla periódica va a ser un poco más complicado a partir de este año. Por primera vez desde que el ruso Dmitri Mendeléyev crease este catálogo en 1869, diez elementos clave van a cambiar su peso atómico. Las nuevas cifras, que aparecerán a los pies de cada elemento, expresan la minúscula pero relevante diferencia de peso que hay, por ejemplo, entre el hidrógeno que contiene una gota de agua salida de un grifo en París y el que hay en la misma cantidad de líquido recogida en una playa de Almería. La diferencia depende del número de neutrones que haya en cada átomo y, por eso, el nuevo peso atómico deja de ser una cifra cerrada para convertirse en un intervalo.
"Me parece excelente crear este nuevo problema a los estudiantes", explica a Público Tyler Coplen, uno de los artífices de la reforma. Este miembro de la Unión Internacional de Química Pura y Aplicada (IUPAC, en inglés) es coautor del estudio que, tras 15 años de investigación, ha hecho oficiales los cambios de los diez elementos en cuestión.
La frecuenciade cada isótopo se expresará con un gráfico de tarta
El grupo incluye todos los elementos esenciales para la vida en la Tierra menos el fósforo: nitrógeno, oxígeno, hidrógeno, carbono y azufre. Además, el peso atómico del litio, boro, silicio, cloro y talio también se expresará con un intervalo en vez de con una sola cifra. Los cambios se incluirán en una nueva tabla periódica que la IUPAC publicará a principios de este año, según Coplen.
"El valor único del peso atómico que aparecía en la casilla de cada elemento de la tabla periódica daba la impresión de que es un valor universal, y no es así", explica Javier García, miembro de la IUPAC y director del laboratorio de nanotecnología molecular de la Universidad de Alicante. Se debe a que algunos elementos tienen variantes llamadas isótopos y que tienen más o menos neutrones en su núcleo. Uno de los más conocidos es el carbono, recuerda García. El carbono 12 se llama así porque lleva seis neutrones y tantos otros protones. Pero el carbono 14 lleva ocho neutrones. "Los organismos que dejan de respirar dejan de incorporar carbono 14 y los átomos de este isótopo decaen con el tiempo a carbono 12", explica García. "En las muestras orgánicas, el peso atómico del carbono va disminuyendo con el tiempo", añade.
RelatividadOtros ocho elementos podrían cambiar sus pesos atómicos
Por eso los isótopos del carbono permiten datar fósiles o saber si un deportista se ha dopado con testosterona, pues el peso atómico del isótopo de carbono que contiene esta hormona cuando la segrega el cuerpo es mayor que el que contiene la testosterona hecha en un laboratorio. Del mismo modo, los isótopos de cloro o hidrógeno pueden ayudar a localizar una fuente de contaminación en un río.
Los nuevos intervalos de la IUPAC añaden una relatividad a la química que siempre había existido en la naturaleza, pero no en la tabla periódica. Ahora, a la pregunta de cuánto pesan los átomos de hidrógeno que hay en un litro de agua, los estudiantes podrán responder "depende". El hidrógeno, por ejemplo, tiene un rango de entre 1,00784 y 1,00811. En España, dice Coplen, el peso atómico a elegir para hacer el cálculo con agua local sería de 1,00798.
Si de algo no se puede culpar a los más de mil químicos de todo el mundo que forman la IUPAC es de haber tomado una decisión precipitada. La organización comenzó a estudiar en 1985 la frecuencia de cada isótopo. "El otro día vi en CSI que usaban un espectrómetro de masas para saber de dónde venía una muestra de agua en función de los isótopos", confiesa Coplen. "Nosotros llevamos décadas haciendo lo mismo", explica. Una vez concluido el estudio, y tras un proceso burocrático de un año y medio, la IUPAC publicó su decisión final el 12 de diciembre.
Nuevas tartasLa IUPAC publica su nueva tabla periódica para celebrar el Año Internacional de la Química, designado para 2011 por la ONU. Aunque la decisión está aún pendiente de aprobarse, Coplen señala que, para expresar la frecuencia de cada isótopo en la naturaleza, las casillas de cada elemento tendrán un diagrama de tarta (ver gráfico). El alcance de los cambios dependerá de la voluntad de aceptarlos. "No hay una tabla periódica oficial, depende de cada editor", señala Coplen.
Los diez cambios pueden ser el principio de una larga lista. "Con las mejoras en las tecnologías, pueden llegar muchos más", advierte Coplen. Una comisión de la IUPAC ya trabaja en la próxima tanda de elementos que cambiarán sus pesos fijos por intervalos. Son helio, níquel, cobre, cinc, selenio, estroncio, argón y plomo.


Comentarios de nuestros socias/os
¿Quieres comentar?Para ver los comentarios de nuestros socias y socios, primero tienes que iniciar sesión o registrarte.